Place grandissante de la PEGASPARAGINASE dans le traitement des LAL Ph- de l’adulte
Résultats finaux du protocole du Gimema dans le traitement des LAL ph- de l’adulte : incorporation de la pesgasparaginase et intensité thérapeutique stratifiée sur le risque (LAL 1913).
National pegaspargase-modified risk-oriented program for philadelphia-negative adult acute lymphoblastic leukemia/lymphoblastic lymphoma (ph− all/ll). Gimema lal 1913 final results.
D’après la communication orale de R Bassan et al. Abstract #S113, EHA 2022.
Contexte de l’étude
La chimiothérapie d’inspiration pédiatrique est le gold standard de traitement pour les adultes atteints de LAL/LL Ph− avec l’asparaginase comme chimiothérapie incontournable. Depuis 1 an, l’asparaginase native d’Escherichia
Coli n’est plus commercialisée et les groupes doivent repenser l’utilisation de cette drogue. C’est
l’asparaginase dans sa forme pégylée (pegasparaginase) qui est associée au backbone de chimiothérapie dans ce protocole pour les patients de 18 à 65 ans.
Objectifs de l’étude
L’objectif de cette étude de phase 2
est d’établir la faisabilité et l’efficacité d’un régime d’induction et de consolidation contenant de la
pegasparaginase au sein d’une stratégie thérapeutique stratifiée sur le risque. En effet, les indications d’allogreffe sont données par la MRD, le phénotype, la cytogénétique et le caractère d’hyperleucocytaire au diagnostic (ou non). La pegasparaginase
est donnée 4 fois au total, à la dose de 2000 UI/m2 < 55 ans et à 1000 UI/m2 chez les > 55 ans. Le backbone de chimiothérapie est allégé notamment en induction (par rapport au GRAALL) avec moins d’anthracyclines et de cyclophosphamide.
Résultats de l’étude
Sur les 203 patients de l’étude (âge médian 39,8 ans ; 139 LAL B et 64 LAL T), le taux de RC était de 91% (100% en LAL/LL T), avec une incidence cumulée de rechute à 3 ans et une mortalité sans rechute de 24,2% et 12,6%, respectivement ; 60 patients ont reçu une allogreffe. La survie globale (SG), sans événement (EFS) et sans maladie (DFS) était de 66,7%, 57,7%, et 63,3% à 3 ans.
Comme dans les résultats publiés par l’étude française GRAALL, l’âge des patients et la MRD sont des facteurs prédictifs de la survie sans maladie (table 1).
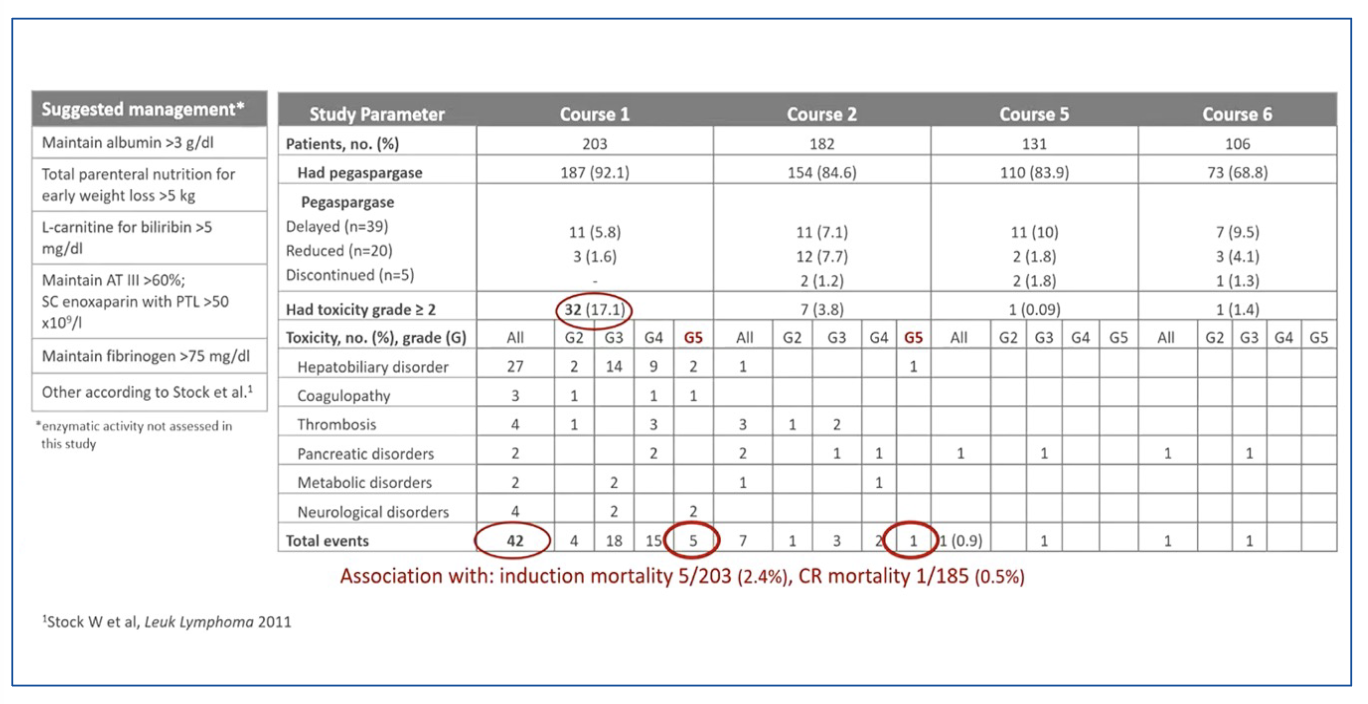
Table 1 : toxicité de la pegasparaginase.
Concernant la pegasparaginase, la figure 1 montre le nombre de patients ayant reçu les différents cycles de chimiothérapie comportant de l’asparaginase (sachant que l’allogreffe se positionnait après le cycle 3 pour la plupart) ainsi que les réductions de dose, les retards d’administration et la toxicité du traitement. Une toxicité grade ≥ 2 a été principalement observée au cours de l’induction (course 1) avec : hépatique 12,8%, coagulation/thrombose 3,2% (alors qu’une prophylaxie à l’énoxaparine était recommandée avec des plaquettes >30-50), pancréatique 1,6%, contribuant à 5 décès en induction (2,4%).
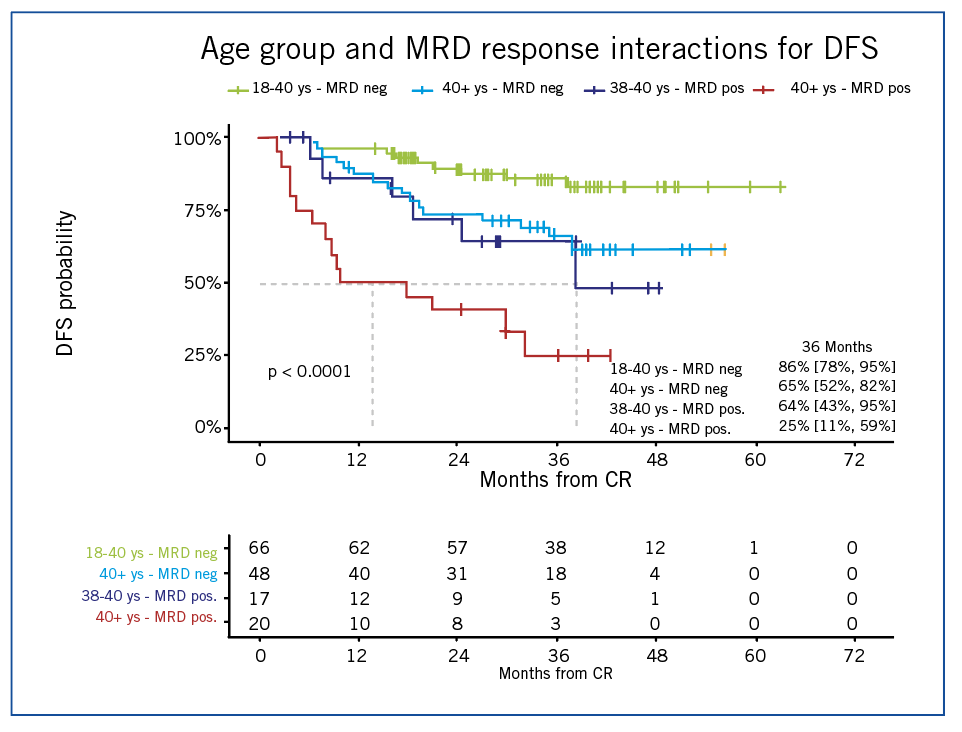
Figure 1 : survie selon âge et MRD.
Quels impacts sur les connaissances et les pratiques cliniques ?
Étude intéressante quant à l’utilisation de la pegasparaginase dans une population adulte. Néanmoins, difficile d’utiliser ce traitement sans monitorer l’activité asparaginase (appelée TDM : therapeutic drug monitoring) indispensable pour détecter une allergie vraie car les patients reçoivent une prémédication. De plus, comme les auteurs le conclus, un algorithme de posologie de la pegasparaginase est nécessaire, basé sur l’âge du patient, l’indice de masse corporelle, la présence d’une stéatose hépatique et certaines toxicités lors d’une exposition antérieure pour minimiser la toxicité. C’est cet algorithme qui est actuellement utilisé dans l’essai GIMEMA en cours associant chimiothérapie séquentielle blinatumomab et pegasparaginase et c’est cet algorithme qui sera utilisé aussi dans le futur protocole GRAALL. Dans ce futur protocole GRAALL, comme le backone initial de chimiothérapie n’a pas été allégé, l’asparaginase utilisée sera celle recombinante d’E. Coli (superposable dans sa demi-vie et son administration à l’asparaginase native connue) et la pegasparaginase se positionnera en intensification retardée, là où la toxicité est moindre (comme le montre cette étude).
Critique méthodologique
Un nombre relativement conséquent de 203 patients a été inclu dans cette étude de phase 2
dont l’objectif primaire a pour endpoint la survie sans maladie (disease-free survival ou DFS) chez les patients en réponse complète (CR). La réponse complète a été reléguée en tant que critère secondaire. Concernant l’objectif principal, les hypothèses formulées en amont prévoyaient une DFS améliorée de 45 à 55% à 24 mois de suivi. Le schéma du protocole est assez complexe, prévoyant une stratégie basée sur le risque du patient selon la MRD en partie, avec une orientation vers deux thérapies : soit une allogreffe, soit de la chimiothérapie de maintenance. Ce qui au final, en tenant compte des patients qui n’ont pas reçu d’allogreffe d’une part, ni de chimio d’autre part, aboutit à 4 groupes de patients. Ceci étant, ils resteront analysés par la suite selon leur groupe “allogreffe” ou “chimiothérapie” pour considérer les patients en intention de traiter (ITT).
En observant la courbe de DFS depuis la réponse complète chez les 185 patients en CR, la probabilité de survie est, dans sa globalité, bien au-delà des 55% prévu avec une estimation faite à 70% [IC de 95% : 63-77] à 24 mois. Le résultat est significativement supérieur à l’hypothèse, synonyme indiscutable de critère primaire atteint. Diverses courbes de DFS ont été présentées afin d’explorer et comprendre ce résultat, montrant la meilleure survie de la population en chimio de maintenance par rapport à celle en intention d’allogreffe post-CR. Ceci est en adéquation avec la meilleure DFS des patients présentant une MRD négative au moment de la stratification. L’âge est également un facteur de risque, les patients de moins de 40 ans ayant une meilleure survie. Des analyses univariées et multivariée ont permis de confirmer l’âge et la MRD (positive versus négative) ainsi que les 2 facteurs principaux impactant la DFS dans cet échantillon. On observe même davantage : la conjugaison de ces deux paramètres. En effet, on observe ce caractère interactif au travers de la figure 1 : les patients MRD-de plus de 40 ans ont une survie similaire aux jeunes patients MRD+. Qu’en est-il de l’immunophénotype ?
L’event-free survival ou EFS (qui n’était pas indiquée dans les critères secondaires et dont on ne connaît pas tous les événements pris en compte dans ce critère composite) est aussi une bonne surprise car avec un suivi maximum de 5 ans environ, la médiane de survie n’est pas atteinte. Les analyses univariées (si on peut considérer ainsi les courbes de Kaplan-Meier avec test de log-rank) sur l’EFS ont permis de voir que les LAL de type B ont plus d’événements au cours du temps que celles de type T. Ceci est probablement dû à un effet délétère des signatures Ph-like parmi les LAL de type B.
De plus, les courbes d’incidence de rechute/résistance, de décès (en fonction de la catégorie d’âge et du type de LAL) sont présentées. Voilà donc une étude de phase 2 dont les résultats et leur teneur sont à la hauteur de l’ambition affichée.