Du soleil à Madrid du côté LAM : des raisons d’espérer pour les patients
On a eu le droit à une pluie de résultats avec les inhibiteurs de ménine qui progressent dans les phases de développement avec une session orale entièrement consacrée à cette classe thérapeutique prometteuse dans les leucémies aiguës avec réarrangement de KMT2A et dans les LAM avec mutation de NPM1.
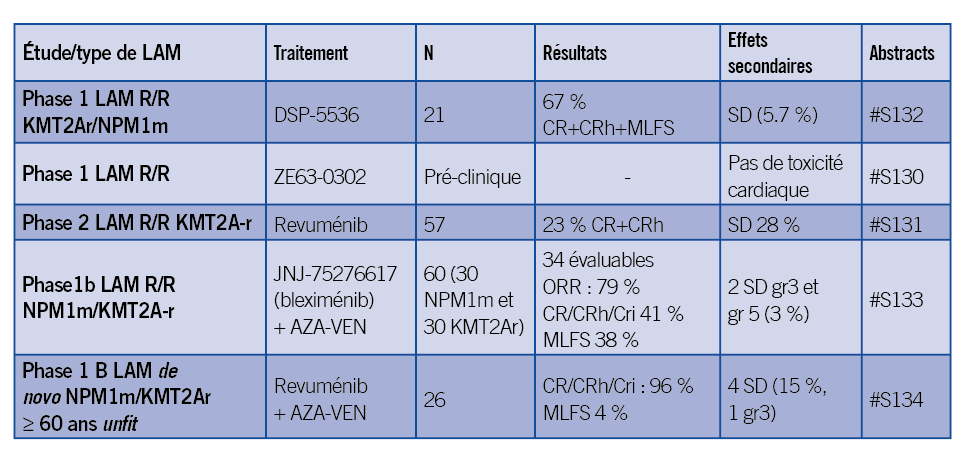
Naval Daver a présenté les résultats actualisés d’une phase 1-2 d’escalade de dose du DSP-5536, un inhibiteur de MENIN-MLL (#S132). Il n’y a pas eu de toxicité limitant l’escalade de dose et les principaux effets secondaires ont été nausées et vomissement (1.8 % de grade 3 ou plus). Un syndrome de différentiation a été observé chez 3 patients (5.7 %). Un total de 21 patients a reçu une dose de 140 mg deux fois par jour au moins et le taux de réponse de la cohorte est de 57 %. Parmi la cohorte de LAM KMT2A-r, 8 patients sur 12 atteints ont eu une réponse objective soit 67 % des patients donc 1 MLFS, RC composite 5 (42 %)
et 2 RC+RCh (17 %). Pour les LAM NPM1m, le taux de réponse est de 4 sur 9 (44 %) dont 1 MLFS, 3 RC+RCh. Sur un plan biologique, les LAM KMT2A-r et NPM1m traitées par le DSP-5536 montrent une diminution de HOXA9, MEIS1, et PBX3 (l’interruption de la liaison Menin-MLL entraîne une diminution de l’expression aberrante de ces gènes et un arrêt du blocage de la différentiation).
Nous avons eu aussi à nouveau une présentation de l’étude AUGMENT 101 dans les leucémies aiguës R/R avec réarrangement de KMT2A (Issa et al., #S131). Les données de 57 patients ont été présentées avec un traitement par revuménib 163 mg/12 heures en association avec un inhibiteur puissant du CYP3A4. La médiane d’âge des patients traités était de 34 ans (1.3-75) et la répartition des hémopathies était la suivante : LAM (86 %), LAL (12 %), MPAL (2 %).
Les patients avaient reçu une médiane de 2 lignes de traitement (46 % > 2 lignes), dont 72 %
un traitement par vénétoclax et 46 % une allogreffe. Une réponse a été obtenue chez 63 %
des patients (CRc+MLFS+PR) dont un taux de RC + RCh chez 13 patients (23 %) et une réponse composite a été obtenue chez 44 % des patients (RC, RCh, RCi, RCp). La majorité des répondeurs avait une MRD négative (70 %).
La réponse semblait la même quel que soit le partenaire de fusion. La médiane de survie estimée était de 8 mois. La médiane de temps pour obtenir la RC a été de 1,87 mois et la durée de rémission de 6,4 mois. De façon intéressante, 39 % des patients ont pu recevoir une allogreffe, seul traitement curatif dans cette situation de LAM en rechute ou réfractaire et le revuménib a été repris chez 50 % des allogreffés. Il y a eu peu d’arrêts de traitement en raison d’évènements indésirables (13 %) et 10 % de réduction de dose. Un syndrome de différentiation a été observé chez 28 % des patients et les principaux effets secondaires étaient digestifs (nausée, vomissement, diarrhée) ainsi que les neutropénies fébriles (38 %).
Un des mécanismes de résistance aux inhibiteurs de ménine est l’acquisition de mutations sur le site de liaison à la ménine par environ 40 % des patients exposés aux traitements par inhibiteur de Ménine pendant plus de 2 mois. Il y a ainsi eu une présentation du baloménib (ZE63-0302), un inhibiteur de ménine de dernière génération qui est très efficace dans des modèles précliniques en monothérapie ou en combinaison avec inhibiteur de BCl2 ou de FLT3. Il a l’avantage de ne pas modifier le QTc. Des résultats très intéressants du fait de l’efficacité sur les mutations de résistance, une phase 1 est en cours (#S130).
A Wei a présenté les résultats de la combinaison azacytidine + vénétoclax + inhibiteur de ménine (JNJ-75276617) (#S133). Cette phase 1b s’adresse aux LAM R/R KMT2A-r ou NPM1m. Le traitement par vénétoclax était administré en escalade de dose initialement avec azacitidine sous-cutanée de J1 à J7 selon le schéma VIALE-A. À partir de J4 le bleximénib était débuté en continu 2 fois par jour avec escalade de dose dans l’étude. Les cycles étaient de 28 jours et la durée d’exposition du vénétoclax n’a pas été modifiée par le rajout du bleximénib et ce dernier a été utilisé aussi longtemps que dans l’étude phase 1 monothérapie. Les effets secondaires ont été sans surprise des neutropénies fébriles dans 37 % (grade ≥ 3) ainsi que thrombopénie et anémie (35 % et 32 % grade ≥ 3). Deux patients ont eu un syndrome de différentiation (SD), 1 grade 3 à la posologie de 100 mg x 2 par jour et un grade 5 à 50 mg x 2 par jour). La réponse a été évaluable chez 34 patients (uniquement KMT2A et NPM1 ayant reçu 50 ou 100 mg x 2 par jour et ayant eu une évaluation médullaire) : une réponse a été observée chez 79 % des patients dont 41% de CR/CRh/Cri et 38 % de MLFS. La réponse a été ensuite évaluée dans les sous-groupes exposés ou non au vénétoclax : 65 % vs 94 % en termes d’ORR. Neufs patients (26.5 %) ont pu recevoir une allogreffe.
Une triplette a été aussi présentée (revuménib + AZA-VEN) mais cette fois-ci dans les LAM de novo NPM1m/KMT2Ar (#S134). La médiane d’âge était de 70 ans (60-85) et 65 % des patients avaient une mutation de NPM1 et 35 %
un réarrangement de KMT2A. IL y a eu une dose limitante toxique sur le plan hématologique au palier 1 (113 mg) mais pas au palier 2 (163 mg).
Un SD a été observé chez 4 patients (1 seul grade ≥ 3 soit 4 %). La médiane de durée du 1er cycle a été de 36 jours (28-49) ce qui explique que 80 % des patients ont eu un recul de la 2e cure en raison de cytopénies. Des réductions de durée de traitement ont été réalisées, d’abord le revuménib (28 jours à 21 jours) puis vénétoclax (28 jours à 21 jours) puis azacitidine (7 jours à 5 jours). Au total, 13 réductions de dose ont été faites chez 5 patients (6 revuménib, 5 vénétoclax, 2 azacitidine). Les taux de réponses sont impressionnants avec 100 % de réponses dont 1 MLFS et 92 % de négativité de MRD. Une allogreffe a pu être réalisée pour 3 patients et une rechute a été observée pour 3 patients également et 11 patients sont encore sous traitement. La survie estimée à 12 mois est de 62.2 %, la mortalité à J60 est de 4 % (1 patient). Une phase 3 est en cours de planification (tableau).
Le vénétoclax a eu aussi sa part lors de cet EHA avec de nombreuses présentations en association avec des chimiothérapies pour les sujets jeunes. La question est en effet de savoir si le vénétoclax peut enrichir l’arsenal thérapeutique des patients « fit ». Il faut par exemple citer l’abstract #S136 avec l’association FLAG-IDA vénétoclax qui donne 99 % de réponse en première ligne (n=68, médiane d’âge 44 ans) notamment dans le groupe défavorable ELN2022, avec une médiane de récupération granuleuse de 25 jours.
En rechute, une mise à jour de l’étude de phase 1-2 SAL/RELAX a été présentée. Il s’agit d’un traitement HAM-vénétoclax en situation de rechute ou réfractaire à l’induction(#S135). Le traitement comprend de la cytarabine 1g/m2/12h de J3 à J5, mitoxantrone 10 mg/m2 J5 à J7 et vénétoclax 400 mg par jour en continu. Cinquante-cinq patients ont reçu le traitement dont 51 sont évaluables pour la réponse. La médiane d’âge est de 55.9 ans et 69 % étaient en rechute, 31 % réfractaires et 34 % avaient reçu une allogreffe préalable et 49 % étaient classés ELN2022 défavorables. La mortalité à 30 et 60 jours a été de 5.5 % et 7.4 % avec une médiane de récupération hématologique de 35 jours. Les réponses au traitement sont les suivantes : 74.5 % de RC+RCi (90.9 % groupe ELN 2022 favorable, 88.2 % groupe intermédiaire, 59.2 % groupe défavorable). Ce traitement a permis une allogreffe chez 80 % des patients en RC et 21.9 % ont pu poursuivre le vénétoclax en maintenance. Une rechute a été observée chez 21.9 % des patients avec une médiane de 4 mois. Après une médiane de suivi de 11 mois, l’estimation de survie à 12 mois et 24 mois est de 62.4 % et 55.5 %, la médiane de survie n’ayant pas été encore atteinte.
Parmi les résultats d’étude définissant un nouveau standard, la présentation orale en plénière de l’étude APOLLO a fait sensation et est détaillée plus loin (#S102).
Un peu de biologie avec les mécanismes de résistance sous VenAza (#S145) : l’analyse de la cohorte VIALE a montré des mutations des gènes régulateurs de la transcription comme RUNX1, pas de mutation de Bcl2, 17 % de mutation de BAX.
L’impact des mutations de type secondaire de l’ELN 2022 a été analysé chez 549 LAM ELN favorables ayant un NGS disponible (cohorte de 3 essais du Hovon-Sakk) (#S147). Des mutations secondaires ont été trouvées chez 80 patients (15 %) qui étaient en médiane plus âgés (60 vs 52) par rapport au groupe sans mutations secondaires (n=469). Un seul patient (1.3 %) avait une inversion 16 dans le groupe avec mutation secondaire contre 16.2 % dans le groupe sans mutation (p=0.004). SRSF2 et STAG2 étaient les mutations les plus fréquentes. Les taux de rémissions étaient de 85 % dans le groupe favorable avec mutation secondaire contre 93.8 % dans le groupe favorable sans mutation secondaire et ceci se traduit par une moins bonne survie : 5y OS 48.8 % versus 68.7 % (p=0.00022). En analyse multivariée, les mutations secondaires, l’âge >60, la mutation de IDH1 et de FLT3, la leucocytose > 20 G/L représentent les facteurs de risque de mortalité. Le pronostic péjoratif des mutations secondaires est surtout vrai au-delà de 60 ans, dans le sous-groupe NPM1m/ FLT3 sauvage et dans le groupe CEBPA mutation in frame B-Zip mais pas du tout dans le sous-groupe t(8 ;21).
Du nouveau et des confirmations du côté LAL
Dans les innovations, il faut noter la présentation de l’étude WU-CART-007 1001 développant un CAR T allogénique de seconde génération ciblant le CD7. Ce CAR T allogénique n’expose pas au risque de prélever des cellules malades, la délétion du TCR évite les risques de GVH grave et la délétion du CD7 évite d’avoir le risque fratricide (#S110). La phase 2 a inclus des patients de 12 ans ou plus avec une LAL-T ou lymphome lymphoblastique en R/R. Après une lymphodéplétion par fludarabine et endoxan, 26 patients ont reçu une injection du CAR T, 13 dans la phase 1 (médiane d’âge de 32 ans) et 13 dans la phase 2 (médiane d’âge de 30 ans) et 9 patients sur les 26 avaient reçu une allogreffe au préalable. Les effets secondaires ont été : CRS de grade 3 pour 3 patients et de grade 4 pour 2 patients, HLH de grade 3 chez 1 patient, 1 GVH de grade 2 répondant aux stéroïdes et 1 patient avec cytopénie prolongée de grade 3. Les taux de réponses pour la phase 2 sont de 91 %, dont 73 % de CR composite avec une médiane de durée de réponse de 6.2 mois. Après une médiane de suivi de 8.5 mois, 46 % sont encore en rémission, et 7 patients ont pu être transplantés. Ces résultats sont particulièrement intéressants dans cette population de très mauvais pronostic avec les traitements actuels.
Côté LAL de la lignée B, l’étude FELIX a été présentée en session orale. Il s’agit d’une phase 1-2 de traitement par Obe-Cel (obecabtagene autoleucel) un CAR T autologue ciblant le CD19 (#S114). Cette étude avait pour but de réduire la toxicité et d’augmenter la persistance du CAR T afin de voir l’impact sur la question de l’allogreffe qui se pose après CAR T cells en général. La dose injectée est divisée en une injection à J1 et une injection à J10, la dose dépendant de la blastose avant lymphodéplétion. Parmi les 153 patients inclus, 127 ont reçu l’infusion d’Obe-Cel : 107 (84 %) avec 5% ou plus de blastes médullaires (cohorte A), 13 (10 %) avec MRD positive (cohorte B), 7 (6 %) avec une localisation extra-médullaire (cohorte C). La médiane d’âge était de 47 ans (20-81), 28 % de LAL B Ph+, une médiane de 2 traitements antérieurs, 15 % avec plus de 3 lignes antérieures, 41.7 % et 31.5 % de patients exposés au blinatumomab et à l’inotuzumab (16.5 % ont reçu les 2), 44.1 % de patients allogreffés antérieurement. Après une médiane de suivi de 21.5 mois, une RC+RCi a été observée chez 99 patients (78 %) et 40 (40 %) sont en rémission encore sans autre traitement, 18 (18 %) ont reçu une allogreffe, 5 % ont débuté un autre traitement et 36 % sont décédés de rechute. La médiane de survie sans évènement avec ou sans censure à l’allogreffe est de 11.9 mois et 9 mois soit une EFS à 12 mois de 49.5 mois et 44 mois. La courbe de survie globale montre un plateau avec une médiane de survie de 23.8 mois (censure à la greffe) et 5.6 mois (non censurée), OS à 12 mois estimée de 63.7 % et 61.1 % avec et sans censure à la greffe. Difficile de savoir l’effet de l’allogreffe compte-tenu des 18 % seulement de patients allogreffés. La persistance ou non des CAR T ou l’aplasie B à 6 et 12 mois sont prédictifs de la rechute.
Nous avons assisté également à la confirmation des résultats de l’étude PHALLCON (#S115) comparant dans une phase 3 randomisée l’imatinib ou le ponatinib en association à la chimiothérapie d’induction/consolidation/post consolidation et de maintenance. La survie sans progression des patients de moins de 65 ans montre un avantage pour le bras ponatinib (médiane PFS 18.7 mois versus 7.3 mois, HR = 0.5 (0.34-0.74). La présentation s’est focalisée sur les réponses profondes et une MRD négative a été obtenue chez 68 % des patients dans le bras ponatinib contre 50 % dans le bras imatinib, la différence étant plus marquée pour les moins de 65 ans. La médiane de PFS est plus longue dans le groupe traité par ponatinib quels que soient l’âge et le type de transcrit p190 ou p210.
La question de la greffe est également analysée et le pourcentage de patients recevant une allogreffe dans le groupe ponatinib a été de 36 % contre 47 % dans le bras imatinib. Parmi les patients répondeurs ayant une MRD négative, le taux d’allogreffe est de 32 % dans le bras ponatinib et 56 % dans le bras imatinib, en rappelant que la décision de l’allogreffe était laissée au médecin du patient. La durée d’exposition au traitement a été 2 fois plus longue dans le bras ponatinib (12.8 mois vs 5.1 mois) et il y a eu davantage d’interruption de traitement en raison d’effets secondaires avec le ponatinib (73 % vs 41 %).
D’autres communications ont confirmé l’intérêt du blinatumomab dans des populations particulières plus difficiles à prendre en charge du fait des toxicités de la chimiothérapie :
en première ligne de traitement dans les LAL-B de risque INT/HR associées au syndrome de Down (#S111) sur les données préliminaires du protocole ALL-TOGETHER DS ;
en consolidation chez les AJA avec les résultats de l’étude SUBLIME (#S112).
Enfin le HOVON a comparé 2 études consécutives pour voir l’effet de l’addition du blinatumomab en pré-phase et consolidation (#S113). Dans l’étude HOVON-146, le blinatumomab est introduit en pré-phase pour 2 semaines puis 1 mois de traitement après consolidation 1 et après les 3 intensifications. Le critère principal était la MRD avant intensification. Soixante et onze patients ont été inclus (médiane d’âge de 53 ans, 18-70), dont 77 % classés Haut risque. Le taux de réponse est de 85 % de RC dont 63 % après la pré-phase (53 % MRD-) et 97 % après le premier mois de blinatumomab (post-consolidation 1, 91 % MRD-). Il y a eu 4 % de CRS de grade 3 et 2 % d’ICANS de grade 3.
Avec un suivi de 43 mois, la survie est de 86 % pour les moins de 40 ans et de 50 % pour les > 40 ans. La mortalité chez les plus de 60 ans est de 50 % (la moitié de rechute et la moitié de toxicité). La comparaison avec l’essai précédent HOVON-100 montre la progression obtenue surtout dans le groupe > 40 ans et pour les LAL-B Ph+. Des résultats impressionnants surtout les taux de réponses après la pré-phase corticostéroïdes puis blinatumomab (63 % de RC), ce qui va légitimer l’introduction précoce du blinatumomab dans nos futurs protocoles.



