Duel d’ITKs : et le gagnant est le ponatinib !
PhALLCON : une étude de phase 3 comparant le ponatinib et l’imatinib dans la LAL Ph+ nouvellement diagnostiquée.
PhALLCON: a phase 3 study comparing ponatinib versus imatinib in newly diagnosed Ph+ all.
D’après la communication orale de Elias Jabbour et al. Abstract #S110, EHA 2023.
Contexte de l’étude
Depuis plusieurs années, l’association chimiothérapie et inhibiteur de tyrosine kinase (ITK) est devenu le standard de première ligne des leucémies aiguës lymphoblastiques Philadelphie positive (LAL Ph+)(1). Les taux de rémission complète moléculaire à 3 mois varient de 14% à 39% avec les ITK de 1ère et 2ème génération(2, 3). Les mécanismes de résistance impliquent fréquemment l’acquisition d’une mutation T315I du domaine kinase d’ABL(4).
Le ponatinib est un ITK de 3ème génération, actif sur BCR-ABL et notamment efficace en cas de mutation T315I (5, 6).
Des combinaisons de chimiothérapie avec ponatinib ont montré une très bonne efficacité avec une survie prolongée. Une étude de phase 2 en association avec l’hyper-CVAD(5) a montré une survie sans évènement à 3 ans de 70% pour des patients nouvellement diagnostiqués. Une étude de phase 2 du groupe italien a montré également que le ponatinib en association aux corticostéroïdes permet 86% de réponse complète hématologique et quasiment 41% de réponse moléculaire complète à 6 mois dans une population âgée de 60 ans ou plus, traitée en première ligne(6).
Ces résultats prometteurs ont conduit à la réalisation de l’étude PhALLCON.
Objectifs de l’étude
Le but de l’étude était de comparer l’efficacité et la sécurité en première ligne d’un traitement associant chimiothérapie de faible intensité et l’imatinib ou le ponatinib. Les patients avec une LAL Ph+ ou BCR-ABL1 positive nouvellement diagnostiqués pouvaient être inclus en l’absence de comorbidité cardiovasculaire non contrôlée, un ECOG de 0-2, en excluant les LMC en phase blastique.
Résultats de l’étude
Les patients recevaient un schéma de chimiothérapie type EWALL avec une induction ITK + vincristine + dexaméthasone puis 6 consolidations mensuelles associant ITK + méthotrexate + cytarabine puis 11 cycles de réinduction mensuelles ITK + vincristine + prednisone et un traitement d’entretien par l’ITK. Dans le bras ponatinib, la posologie était de 30 mg par jour avec réduction à 15 mg en cas de rémission complète avec maladie résiduelle négative en post induction. Dans l’autre bras, l’imatinib était administré à 600 mg par jour. La prophylaxie neuroméningée était assurée par 12 injections intrathécales pendant les 6 premiers cycles.
Deux cent quarante-cinq patients avec une LAL Ph+ nouvellement diagnostiquée ont été randomisés 2:1, soit 164 dans le bras ponatinib et 81 dans le bras imatinib.
Le critère de jugement principal était le taux de MRD négative avec rémission complète (RC) définie par une rémission complète hématologique ≥ 4 semaines et une MRD négative (BCR::ABL1/ABL1 ≤ 0.01% (MR4). Les critères secondaires étaient la survie sans évènement, le taux de réponse moléculaire, la durée de la maladie résiduelle négative, le taux de RC, la survie globale et l’incidence des évènements secondaires reliés au traitement.
La médiane d’âge était de 54 ans (19-82) et 52 ans (19-75) dans les bras pona et ima, respectivement, dont 37% ≥ 60 ans dans les 2 bras. Les patients avaient un excellent état général avec un ECOG 0 ou 1 pour 96% des patients du bras ponatinib et 94% du bras imatinib.
Cinquante-six pour cent des patients avaient ≥ 1 comorbidité cardiovasculaire et 28% ≥ 2 comorbidités cardiovasculaires (bras ponatinib) contre 64% et 33% (bras imatinib).
La médiane de suivi a été de 20.4 mois (18.4-23.9) dans le bras ponatinib contre 18.1 mois (13.9-24.3) dans le bras imatinib.
En août 2022, 41% des patients étaient encore sous traitement par ponatinib contre seulement 12% dans le bras imatinib. L’arrêt de l’imatinib était motivé par un manque d’efficacité (26%), une greffe (37%) et 12% en raison d’effets indésirables. L’arrêt du ponatinib a été réalisé en raison d’une allogreffe (30%), un manque d’efficacité (7%), ou évènements indésirables (12%).
Une allogreffe a été réalisée chez 34% des patients du bras ponatinib et 48% dans le bras imatinib.
L’efficacité (critère principal) est montrée dans la figure 1 : 16.7% de RC avec MRD négative dans le bras imatinib contre 34.4% dans le bras ponatinib (RR 2.06 ; IC95% [1.19-3.56], p=0.0021) soit 2 fois plus dans le bras ponatinib. Si on regarde uniquement la MR4 (BCR::ABL1≤0.01%) à la fin de l’induction indépendamment du critère de RC, on trouve également un doublement du taux de réponse passant de 20.5 à 41.6% dans le bras ponatinib (RR 1.94 ; IC95% [1.19-3.17], p=0.0017) (figure 1).
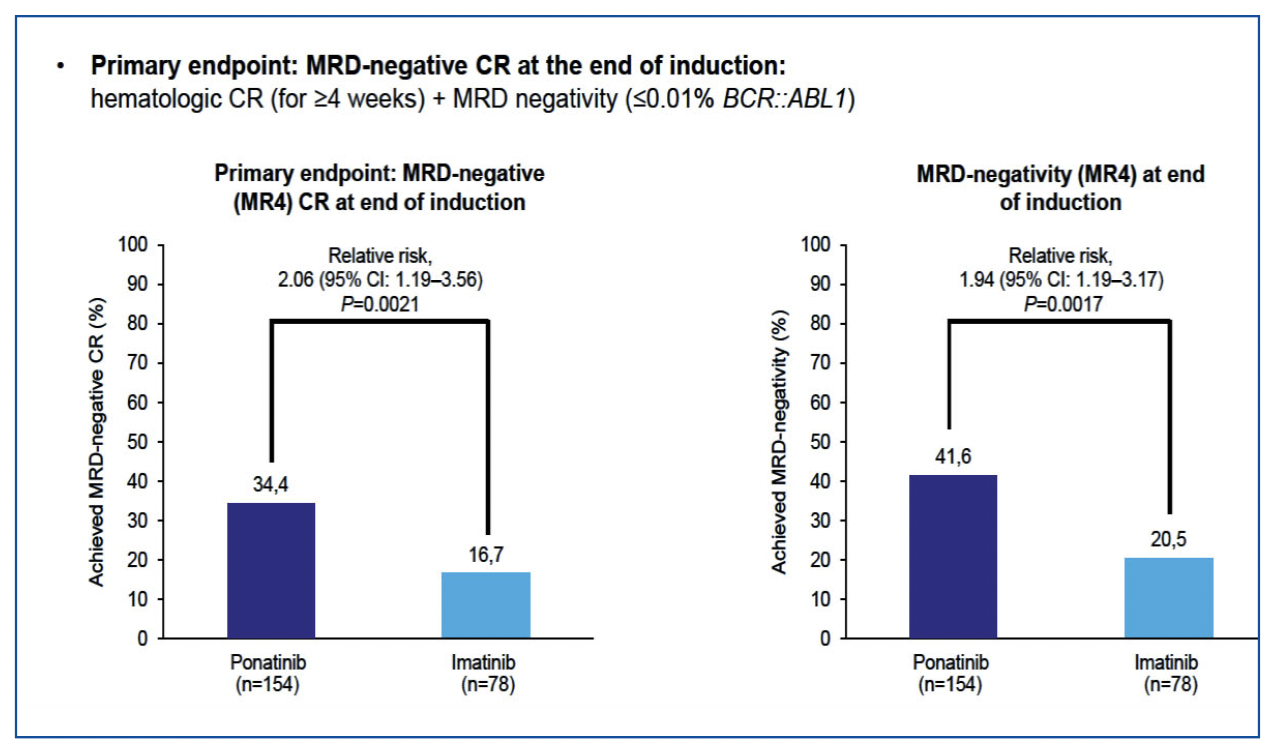
Figure 1 : évaluation du critère principal.
Rémission complète avec MRD BCR-ABL:ABL négative après induction et MRD BCR-ABL:ABL négative post-induction selon le bras de traitement.
Le ponatinib induit une réponse MR4 plus fréquente aux cycles 3, 5, 7 et 9 (43%/63%/70%/92% de réponse MR4) contre 22%/52%/ 40%/47% de réponse MR4 pour l’imatinib. Les réponses MR4.5 (BCR::ABL1≤0.0032%) sont également meilleures dans le bras ponatinib aux même cycles 27%/40%/48%/63% versus 15%/30%/25%/27% dans le bras imatinib.
La durée de réponse était plus longue dans le bras ponatinib (médiane non atteinte) contre 20.9 mois dans le bras imatinib avec toutefois seulement 8 évènements dans le bras ponatinib sur 62 patients et 3 évènements sur 15 dans le bras imatinib. La médiane de temps jusqu’à l’arrêt du traitement pour échec (défini par arrêt du traitement de l’étude pour des raisons d’effet secondaire ou perte d’efficacité sauf pour les patients allogreffés) est également non atteinte dans le bras ponatinib versus 21.9 mois dans le bras imatinib. Dans le bras imatinib, 37% des patients ont reçu un ITK 2G ou ITK 3G et/ou une immunothérapie contre seulement 19% dans le bras ponatinib. Enfin 16% des patients du bras imatinib ont finalement reçu du ponatinib ensuite.
La survie sans évènement (décès, absence de RC à la fin de l’induction ou rechute après une RC) est supérieure dans le bras ponatinib (médiane EFS non atteinte contre 29 mois dans le bras imatinib HR0.65 ; IC95% [0.39-1.10])
La PFS (définie par décès, absence de RC post-induction, rechute, absence de MRD négative ou perte de MRD négative) est supérieure dans le bras ponatinib avec une médiane de 20 mois contre 7.9 mois pour le bras imatinib (HR 0.58 ; IC95% [0.41-0.83]), figure 2).
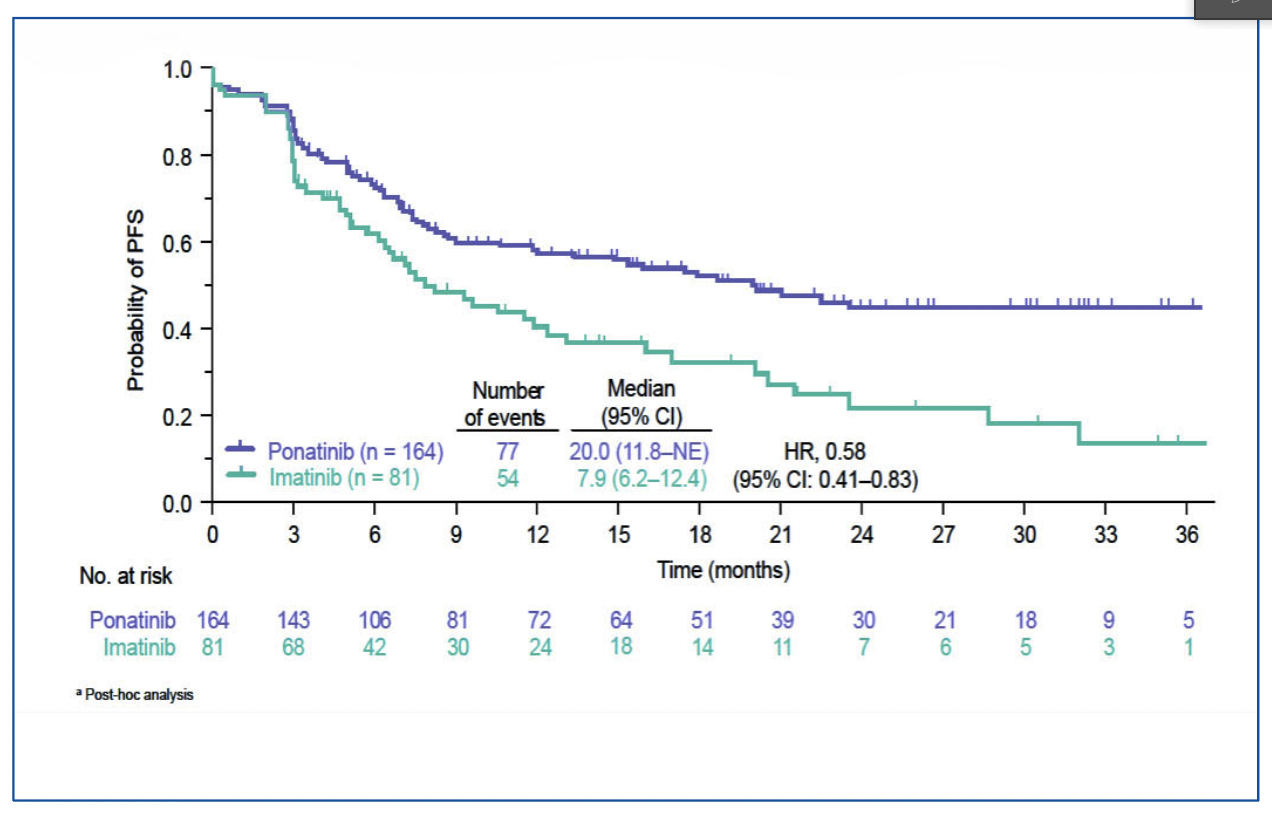
Figure 2 : survie sans progression selon le bras de traitement.
La médiane de survie globale est non atteinte dans les 2 bras de traitement (HR 0.76 ; IC95% [0.38-1.52]) ce qui peut s’expliquer par le switch d’ITK et/ou l’immunothérapie utilisée en cas d’échec avec l’imatinib.
Un point très important reste la fréquence des évènements reliés au traitement. Il y a eu davantage d’HTA dans le bras ponatinib (12% grade 3-4 versus 6%) et d’élévation ALAT (19% grade 3-4 versus 9%). à noter 19% d’hypokaliémie grade 3-4 avec l’imatinib contre 6% pour le ponatinib. Il n’y a pas eu de différence d’hématotoxicité notamment en termes de neutropénie fébrile (23% (grade 3-4 versus 19%). Fait important, aucune différence n’a été observée en termes d’évènement thrombotique artériel (2% versus 1%) et veineux (12%) entre les 2 bras.
Quels impacts sur les connaissances et les pratiques cliniques ?
Cette étude démontre avec un haut niveau de preuve la supériorité d’un traitement de première ligne de chimiothérapie + ponatinib par rapport à l’imatinib. Cette étude va modifier la prise en charge des patients nouvellement diagnostiqués.
D’autres études de chimiothérapie+ ITKs dans la LAL Ph+ ont été réalisées antérieurement. Une phase 2 a montré des taux de rémission complète de 96%, réponse moléculaire majeure de 60% et MR5 de 20% en post-induction avec le dasatinib(4) mais des courbes de survie sans événement et survie globale moins bonnes avec toutefois un follow-up plus long. Une étude associant chimiothérapie intensive avec du nilotinib a montré des taux de rémission moléculaire complète de 77% à 3 mois et une survie globale de 72% à 2 ans(7). La stratégie chimiothérapie faible dose avec un ITK de 2ème ou 3ème génération reste la meilleure actuellement. L’allogreffe reste un standard de traitement chez les patients jeunes avec une LAL Ph+ et des facteurs de risques (MRD positive). Chez les patients avec une maladie résiduelle négative, le devenir à long terme est le même chez les patients allogreffés ou non (8). Le rôle de l’allogreffe reste discutable avec les ITK de dernière génération qui offrent un taux de rémission moléculaire impressionnant et une survie excellente. Chez les patients non éligibles à une greffe, un traitement de chimiothérapie réduit avec ponatinib parait logique afin d’éviter la résistance liée à la mutation T315I.
Critique méthodologique
Nous sommes dans le cadre d’un essai de phase 3 randomisé, laissant le choix entre un ITK de 1ère génération (imatinib) versus un ITK de 3ème génération, le traitement d’intérêt ici étant le ponatinib. Le ratio des deux bras est de 2 (pour Pona) pour 1 et tous deux bénéficient d’une chimiothérapie de basse intensité. Le critère principal de l’étude est un critère combinant à la fois : réponse complète durant 4 semaines d’affilée plus une MRD négative (taux de BCR-ABL1 < 0.01% ou RM4) après l’induction. La survie sans événement (SSE) est un critère secondaire (avec comme événements les décès, échec de réponse à la fin de l’induction et/ou perte de réponse complète), avec une durée de suivi médiane un peu courte (autour de 19 mois).
Les deux bras avaient des caractéristiques similaires, signe que la randomisation s’est bien déroulée : nul besoin d’ajustement donc (il n’y a pas d’indication s’il y a eu de stratification sur certains facteurs ou non cela étant). Des points importants à noter avant d’analyser le critère primaire au moment du cut-off de l’étude (datant d’août 2022) : 41% des patients sous ponatinib étaient encore sous traitement contre seulement 12 % pour l’imatinib, alors que les pourcentages d’arrêts d’étude étaient proches (18 pour Pona contre 22 pour Ima). Aussi, le nombre de greffe (à n’importe quelle période) était significativement supérieur pour le bras Ima (48% pour 34% pour Pona). L’essai est concluant dans la mesure où l’endpoint primaire était atteint dans une proportion deux fois plus importante pour Pona par rapport à Ima (p=0.002). Pour compléter ce résultat, les auteurs ont montré par la suite que ce taux de réponse perdurait au fil des cycles, mieux il continuait d’augmenter pour Pona alors qu’il stagne pour Ima. Une courbe d’incidence cumulative de RM4 (avec risques compétitifs) aurait été plus adaptée que des histogrammes pour appuyer ce résultat sur la durée.
Si les auteurs jouent la transparence en montrant une courbe de durée de MRD négative pour les patients ayant atteint cette réponse (depuis la date d’obtention de MRD- naturellement), on constate que les conservations de cette négativité ne sont pas différentes entre les 2 traitements (pas de p-value) et qu’on manque de recul. Le léger mieux du Pona en termes de SSE n’est pas démontré sur le plan statistique (HR=0,65 [0.39-1.10]). En revanche pour la survie sans progression ou SSP (qui intègre davantage d’événements dans sa définition comme l’absence de MRD- ou la perte de MRD-), le Pona donne de bien meilleurs résultats (HR=0,58 [0,41-0,83], significatif). À 36 mois, la SSP est mauvaise pour le bras Ima (moins de 20%).
Malgré cela, les survies globales étaient comparables. Ceci pose la question de l’utilisation des censures des courbes de survie : l’ont-elles été au moment de la prise de traitements ultérieurs ou de greffe ? Car ces interventions au cours du suivi peuvent en effet redresser les courbes de survie.
Références :
- Soverini S et al. Cancer 2014; 120:1002-09.
- Ottman OG et al. Blood 2018.
- Ribera JM et al. BJH 2012 ;159 : 78-81.
- Rousselot P. et al ; Blood 2016 ;128 :774-782.
- Jabbour E. et al. Lancet Haematol 2018 :e618-e627.
- Martinelli G et al. Blood Adv. 2022 ;6 :1742-1753.
- Kim DY et al. Blood 2015 ; 126 : 746-756.
- Chalandon Y et al. Blood 2015 ; 125 :3711-3719.




