L’asciminib, dont l’AMM actuelle le place en 3ème ligne dans la LMC PC, essaie de remonter les lignes en association !
L’asciminib en combinaison et en première ligne dans la LMC en phase chronique : premiers résultats de l’étude FASCINATION.
Frontline asciminib combination in chronic phase chronic myeloid leukemia
patients. The fascination trial.
D’après la communication orale de Thomas Ernst et al. Abstract #S156, EHA 2023.
Contexte de l’étude
L’étude FASCINATION (The Frontline ASCIminib in combiNATION) est une étude multicentrique prospective de phase 2 qui évalue l’efficacité et la tolérance de l’asciminib (un inhibiteur allostérique de la kinase ABL) en association avec un inhibiteur de tyrosine kinase compétitif de l’ATP (nilotinib, dasatinib, ou imatinib), en première ligne chez des patients atteints de LMC en phase chronique.
Le rationnel de ces associations est d’essayer de maximiser le taux de réponse profonde (RM4) au terme de la première année de traitement, l’idée étant d’amener plus de patients à l’arrêt de traitement (TFR).
Objectifs de l’étude
Cet abstract donne les résultats de l’analyse intermédiaire sur l’objectif primaire de l’étude FASCINATION : taux de RM4 (transcrit BCR::ABL1 ≤0.01%) au terme de la première année de traitement.
En effet, les patients adultes avec une LMC au diagnostic ont été répartis parmi 4 groupes (tableau 1) :
- NILOTINIB 300BID + ASCIMINIB 20BID
- NILOTINIB 300BID + ASCIMINIB 40QD
- DASATINIB 100QD + ASCIMINIB 80QD
- IMATINIB 400QD + ASCIMINIB 60QD
L’asciminib débute 3 mois après le début de l’ITK compétitif de l’ATP et après reconstitution de l’hématopoïèse.
Résultats de l’étude
Entre 2019 et 2022, 125 patients ont été traités avec l’association de traitement (66% d’hommes). L’âge médian au diagnostic est de 45,5 ans et les scores ELTS étaient « bas » chez 57,3% des patients, « intermédiaire » chez 28,1%, et « haut » dans 14,6% des cas.
Les effets secondaires grade 3-4 sont observés chez 37,6% des patients, (figure 1). Au total, 21 patients (17%) ont arrêté l’association dans les 12 premiers mois à cause de toxicités dermatologiques (=4), gastro-entérologiques (=4), échecs ou progressions (n=3), cytopénies (n=2), œdème papillaire (n=1), polyneuropathie (n=1), douleur (n=1), inobservance (n=1) ou retraits de consentement (n=4).
Au total, 114 patients ont été éligibles à l’évaluation de la réponse moléculaire au 12ème mois : le taux de RM4 était à 37,7% (tableau 1).
Quels impacts sur les connaissances et les pratiques cliniques ?
Il est peu probable que dans les années à venir, nous utilisions ce type d’associations en première ligne car il n’y a pas de réel besoin à ce stade-là de la prise en charge. Ces associations sont certes très efficaces mais toxiques. En revanche, on attend plus de la suite de l’étude avec les résultats à 24 mois, à 36 mois et au-delà, le reflet du traitement de « maintenance ».
En effet, l’étude se poursuit, avec, à 24 mois de l’association initiale :
- les patients obtenant la RM4,5 poursuivent avec l’ asciminib en monothérapie pour une année supplémentaire avant de pouvoir arrêter le traitement ;
- les patients qui obtiennent la RM4 poursuivent l’association (ITK + asciminib) jusqu’à l’arrêt de traitement ;
- et pour ceux qui n’obtiennent pas la RM4, ils continuent leur parcours thérapeutique avec uniquement l’ITK compétitif de l’ATP au long cours sans asciminib.
L’asciminib, inhibiteur spécifique de la poche myristoyl (appelée STAMP inhibitor pour Specifically Targeting the ABL Myristoyl Pocket) est actuellement commercialisé en 3ème ligne chez des patients intolérants ou résistants ; dans les années à venir la courbe d’apprentissage des médecins utilisant cet ITK va se peaufiner et son spectre d’utilisation va sûrement s’élargir (en 2ème ligne ?
en association ? Etc.).
Critique méthodologique
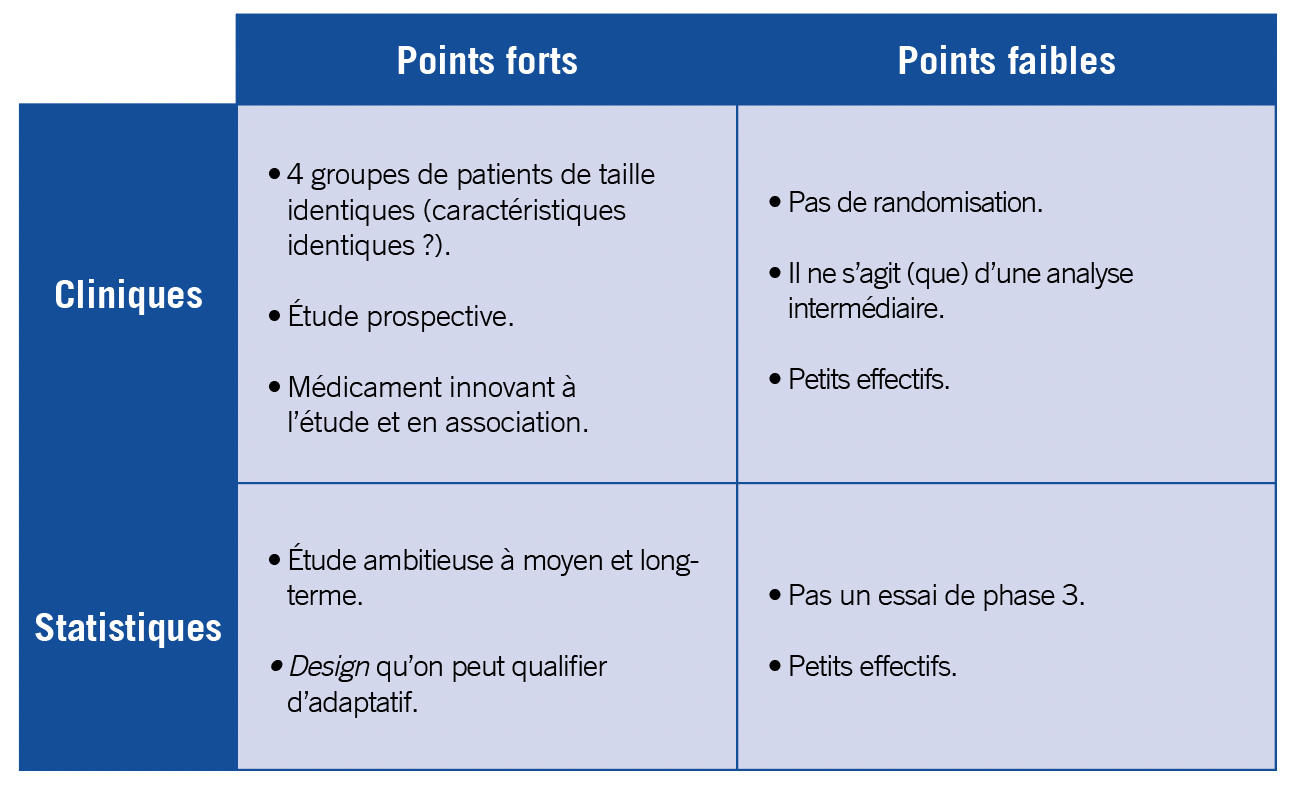
L’étude présentée ici est prospective et non-randomisée, constituée de quatre bras associant l’asciminib à un autre ITK (parmi le trio classique imatinib, dasatinib et nilotonib), chaque bras comprenant entre 30 et 32 patients. Au total 144 patients ont été recrutés sur 3 ans, ce qui reste peu. Cent vingt-cinq patients ont reçu de l’asciminib et 114 ont pu être évaluables 12 mois après initiation de l’ITK. C’est la RM4 (soit un taux de BCR::ABL1 inférieur à 0,01%) qui sera évaluée à ce timepoint, il s’agit du critère primaire. Cette étude n’en reste pas moins ambitieuse sur le papier car à 24 mois sera évalué le taux de réponse moléculaire (RM), à 36 mois le taux de treatment-free remission (TFR), puis jusqu’à 60 mois afin d’analyser le taux de perte de réponse peut-on supposer (puisqu’il est question de scruter la durabilité de la TFR). Le schéma de l’étude est, d’une certaine manière, adaptatif car le maintien des ITKs et de l’asciminib dépendra des réponses à 24 et à 36 mois. Il reste à espérer de ne pas trop perdre de patients en cours d’essai afin d’éviter d’avoir de petits effectifs à comparer.
Après re-vérification par des tests de Chi-2, les caractéristiques des patients semblent similaires entre les 4 groupes en ce qui concerne le sexe-ratio, les types de transcrits et les scores ELTS. Nous n’étions hélas pas en mesure de vérifier si les distributions d’âge étaient proches ou non entre les différents bras : la médiane d’âge globale était de 45,5 ans, avec une médiane de 58 ans pour le bras imatinib+asciminib contre 39 ans pour le bras dasatinib+asciminib. En regardant ces statistiques, la différence reste tout de même notable (sans pour autant savoir si elle est significative). Ceci étant, ajuster les résultats en fonction de l’âge n’est pas nécessaire, car l’âge est un critère d’indication de traitement. Les taux de RM4 à M12 (le critère primaire) dans les différents bras étaient les suivants : 32,1% pour le bras nilo+asciminib 20 mg, 41,9% pour nilo+asciminib 40 mg, 33,3% pour dasa+asciminib et 42,9% pour ima+asciminib. La p-value n’était pas indiquée, nous l’avons calculée : p=0,767 (avec un simple test de Chi-2).
Comme écrit plus haut, il reste à souhaiter que les effectifs, déjà peu importants (étant donné qu’il n’y a pas eu de calculs de sample size), restent stables d’ici 5 ans. Dans le cas contraire les auteurs risquent de passer au travers de conclusions solides sur les nombreux critères secondaires. En effet des différences relativement importantes entre bras pourront ne pas être considérées comme statistiquement significatives si les effectifs sont trop réduits, ou à l’inverse ils risquent de manquer de puissance si des résultats sont faiblement significatifs. Des incertitudes ne pourront pas être levées, ce qui générerait une immense source de frustration. Ceci rappelle bien l’écart existant entre une étude prospective et un essai clinique de phase 3, et repose aussi la question de l’utilité des critères primaires précoces.