Leucémie myéloïde chronique à l’EHA 2023
Le pronostic de la leucémie myéloïde chronique a été révolutionné par l’avènement des inhibiteurs de tyrosine kinase (ITK) compétitifs de l’ATP depuis les années 2000 avec l’arrivée de la première génération avec imatinib, puis de la 2ème génération avec dasatinib, nilotinib et bosutinib et enfin la 3ème génération avec le ponatinib. Depuis, les courbes de survie globale sont les meilleures jamais atteintes en hématologie chez l’adulte et l’espérance de vie est superposable à celle de la population générale dès lors que le traitement est efficace(1).
Les objectifs, dans cette pathologie, se sont donc modifiés au fil du temps pour passer de la survie désormais acquise à l’arrêt de traitement, la qualité de vie (avec le maniement des effets secondaires), et un regard sur l’économie de la santé avec la prescription de génériques. De plus en plus de schémas de réductions de doses sont proposés en cas d’inéligibilité à l’arrêt de traitement ou en cas d’échec d’arrêt de traitement ou encore en cas d’effets secondaires. Il n’en demeure pas moins qu’il existe encore, dans de rares cas, des besoins médicaux non couverts d’où une recherche pharmaceutique encore appuyée et l’arrivée de l’asciminib depuis peu en officine de ville.
L’asciminib
L’asciminib est un inhibiteur de tyrosine kinase dit « inhibiteur allostérique » qui empêche la protéine ABL1, en bloquant la poche myristoyl, d’être en conformation active ouverte. Il s’agit d’un inhibiteur STAMP (Specifically Targeting the ABL Myristoyl Pocket) et qui se différencie des autres ITK prescrits dans la LMC qui sont dits « compétitifs du site de l’ATP ».
Suite aux résultats de l’étude ASCEMBL(2,3), l’asciminib, a depuis peu, l’AMM en 3ème ligne ou plus dans le traitement des patients adultes présentant une LMC-PC sans mutation T315I. Ce médicament se différencie notamment du ponatinib par un profil de toxicité différent, sans alerte sur le compartiment cardio vasculaire.
Dans les différents congrès ces 2 dernières années, il est rapporté des données de combinaison d’ITK avec de l’asciminib ou des tentatives de positionner l’asciminib plus tôt dans l’arsenal thérapeutique de la LMC. Ces combinaisons d’ITK semblent néanmoins être toxiques, non adaptées à la première ligne. Peut-être que leur place est à discuter dans les lignes avancées, lorsqu’il existe des mutations (surtout composites) du domaine kinase d’ABL. Les cliniciens doivent désormais faire leur propre courbe d’apprentissage avec ce médicament, nous rentrons dans l’aire de la phase 4 pour l’asciminib.
Un des autres points phares du traitement de la LMC est l’arrêt de traitement et son optimisation. C’est d’ailleurs un des « principaux objectifs pour tout patient, quel que soit son âge » écrit noir sur blanc dans les recommandations ELN 2020(4). On considère qu’environ 30% des patients atteints de LMC auront les critères l’éligibilité d’arrêt de traitement au cours de son parcours de soin.
L’arrêt de traitement
L’étude EUROSKI (European Stop TKI) est une étude de très grande envergure sur cette thématique qui a permis d’avancer et de comprendre les points à optimiser pour rendre l’arrêt fructueux. Avec notamment les facteurs prédictifs d’une TFR soutenue dans le temps. La réponse moléculaire, même si incontournable, n’est pas le seul critère pour maximiser les chances de succès à l’ arrêt de traitement à long terme (au-delà de 3 ans) : la durée globale d’exposition aux ITK, la durée de la réponse profonde mais aussi le type de transcrit BCR-ABL1 et la blastose périphérique au diagnostic sont des critères d’importance (voir abstract #S155 ci-après).
à noter donc que la NFP au diagnostic est importante, pour le calcul des scores pronostic (ELTS) mais aussi pour la TFR, tout comme la mesure de la rate qui reste un point clinique clé (voir abstract #S151 ci-après).
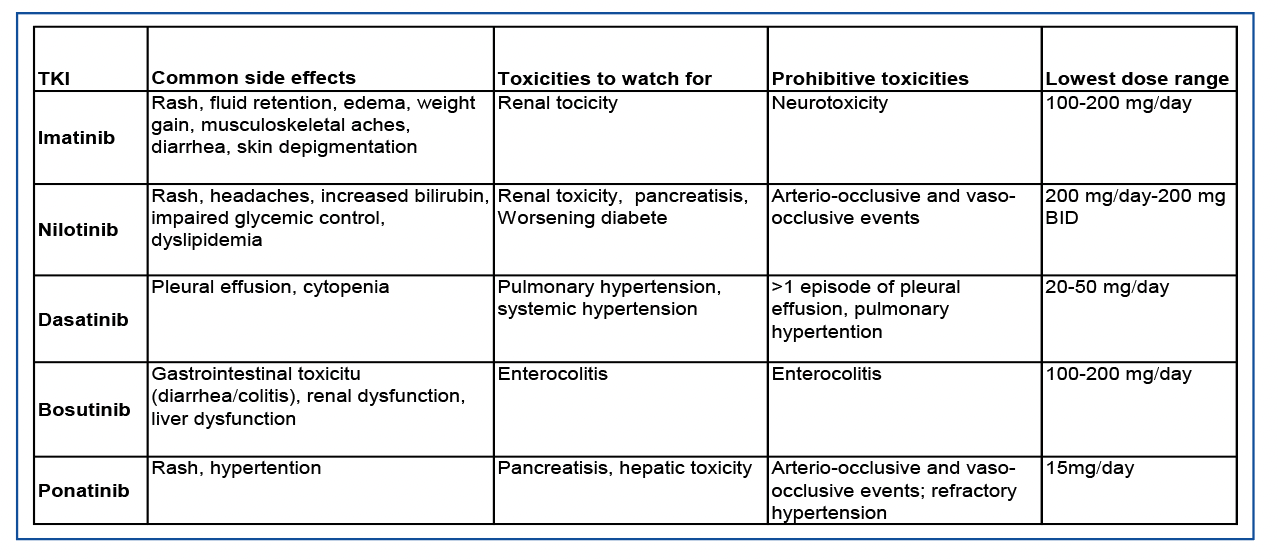
Tableau 1 : toxicité des ITK et schémas de dose réduits (d’après Senapati et al, Blood cancer journal 2023).
Pour finir, l’arrêt de traitement permet d’améliorer la qualité de vie chez de nombreux patients (notamment les plus jeunes) avec, surtout une fatigue décroissante à l’arrêt du traitement chez les 18-60 ans ; ces données ont été rapportés par Fabio Efficace en marge de l’étude EUROSKI (abstract #S159).
Si pas d’arrêt de traitement, la recherche de dose minimale efficace
Pour ceux qui n’atteindront pas les critères d’arrêt de traitement ou bien même dans les premières années de traitement, une fois la RMM obtenue, la recherche de la dose minimale efficace ou « response adapted dosage » fait désormais consensus. Les données de vie réelle ont appris aux hématologues que les posologies établies dans les études d’enregistrement des ITK sont finalement peu « respectées » au long cours, une fois la RCC (réponse cytogénétique obtenue soit BCR::ABL1 < 1% ou RMM obtenue < 0,1%). Les études comme celle présentée dans l’abstract #S158 corroborent cette pratique désormais routinière.
Références :
1- Bower et al. JCO 2016.
2- Rea et al, Blood 2021.
3 -Hochhaus et al, Leukemia 2023.
4- Hochhaus et al. leukemia 2020.



