Temps forts sur la leucémie aiguë lymphoblastique (LAL)
Les grandes actualités thérapeutiques dans la LAL tournent autour de 3 grandes thématiques : les CAR T cells, le chemo free dans les LAL Ph+ et l’optimisation des immuno-chimiothérapies dans un but de réduction des toxicités et de gain d’efficacité.
Chemo free dans la LAL Ph+
Les immunothérapies et les thérapies ciblées prennent une place prépondérante dans le traitement des LAL, qu’elles soient Ph+, Ph- ou Ph-like. De plus en plus, le blinatumomab apparaît comme la drogue incontournable.
Dans le cadre particulier des LAL Ph+, déjà en 2020, les italiens rapportaient les résultats excellents de l’association ITK-blinatumomab(1). L’étude intitulée D-ALBA était une étude multicentrique de phase 2 menée chez des patients atteints d’une LAL Ph + et qui recevaient, en première ligne, l’association dasatinib-blinatumomab. Avec ce type de traitement chemo-free, à 18 mois, la survie globale (SG) était de 95% et la survie sans maladie (SSM) de 88%.
Cette année, les résultats de l’association ponatinib (ITK 3G) associé au blinatumomab ont été présentés par l’équipe du MD Anderson (Short et al, abstract S114). Les patients recevaient jusqu’à 5 cycles de blinatumomab et le ponatinib était prescrit à 30 mg/j pendant le 1er cycle et diminué à 15 mg/j une fois la réponse moléculaire complète obtenue et continué pour une durée totale de 5 ans ; 12 injections intrathécales prophylactiques étaient associées. Au total, 55 patients ont été traités : 35 avec LAL Ph+ nouvellement diagnostiquée, 14 avec une LAL Ph+ en rechute ou réfractaire et 6 avec une transformation aiguë lymphoblastique secondaire à une LMC. Dans la première cohorte « LAL Ph+ de novo » l’EFS et la SG à 2 ans sont toutes deux de 93 % (figure 1). Il n’y a pas eu de rechute ou de décès liés à la leucémie dans cette cohorte.
Il s’agit donc, là encore, d’excellents résultats qui placent l’association ITK-blinatumomab comme une stratégie de choix dans le traitement des LAL Ph+, avec la question de la place de l’allogreffe à l’heure du ponatinib qui reste entière.
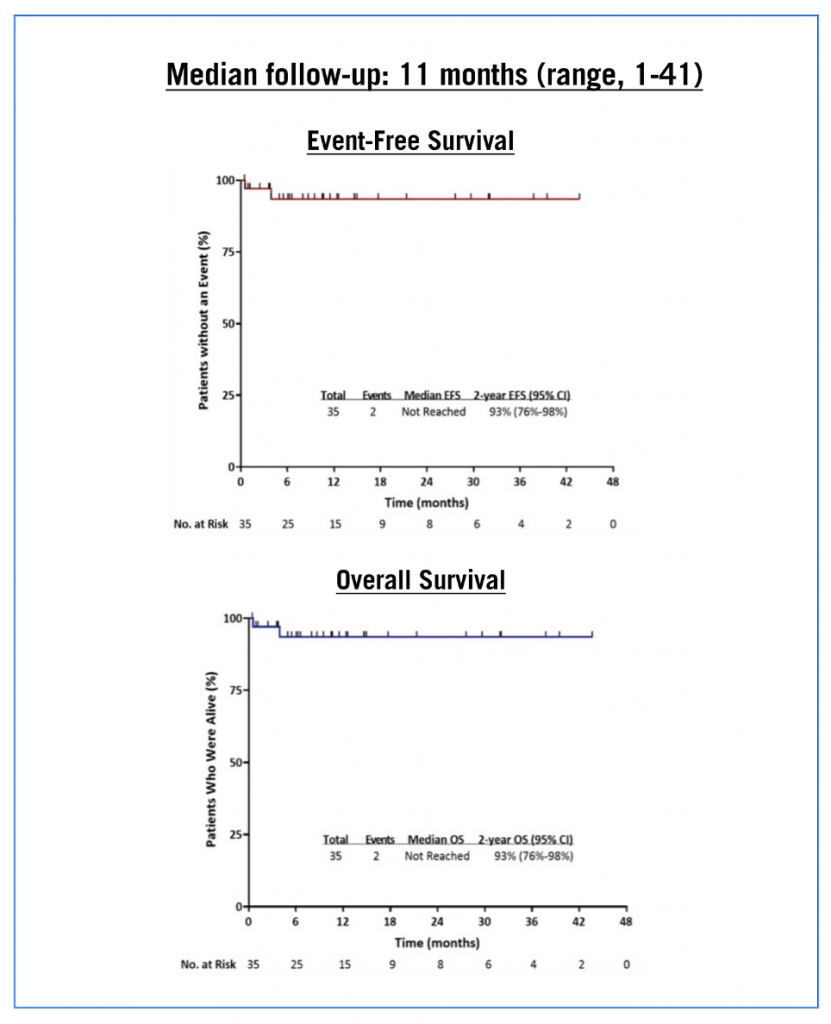
Figure 1 : survie des patients ayant une LAL Ph+ de novo.
Les CAR T cells
Les CAR T et leurs dérivés continuent à faire l’actualité lors de l’EHA 2022. Ces thérapies, bien que révolutionnaires, soulèvent encore des questions.
Quelle est la place des CAR T cells dans la stratégie actuelle de traitement des LAL ? Faut-il considérer ces médicaments comme un « bridge to transplant », ou comme un traitement « de consolidation » ? Par ailleurs, les rechutes CD19 négatives restent le problème principal et ouvrent le champ pour les CAR T bispécifiques, STAR T, etc. De même que les pertes précoces de CAR qui sont un problème de persistance à améliorer par l’utilisation d’inhibiteurs de checkpoints par exemple. Quelle chimiothérapie d’attente ?
On sait que les fortes masses tumorales sont associées à la rechute et au risque de syndrome de relargage cytokinique et les maladies sont de plus en plus chimiorésistantes au fur et à mesure que l’on avance dans les lignes. Les délais d’obtention des CARs est à optimiser, il faut développer des circuits de production courts, les CAR allogéniques, et réduire au maximum les coûts en faisant une place grandissante aux CAR académiques. Pour finir comme dans le lymphome et le myélome où les indications de CAR s’élargissent, la LAL T reste pour l’instant le « parent pauvre » mais les espoirs sont permis au vu des communications qui ont été présentées.
• ELIANA
Une actualisation des données à 5 ans a été présentée cette année à l’EHA. On rappelle que dans cette étude de phase 3 ELIANA, le CAR T employé est le tisa-cel ; un CAR T cell autologue anti CD19, comportant un domaine de costimulation 4-1 BB(2).
Sur les 79 patients réinjectés (médiane âge = 11 ans), 64 patients ont un suivi > 5 ans. La survie sans rechute et la survie globale à 5 ans sont de 44 et 55 % respectivement (figure 2). L’atout d’un suivi si long est de pouvoir mettre en évidence des rechutes (pas de plateau « confortable » atteint sur la figure 2) et des effets secondaires tardifs, apparaissant après 1 an. Concernant ceux-ci, on note essentiellement les infections (33%) et les cytopénies persistantes (10%).
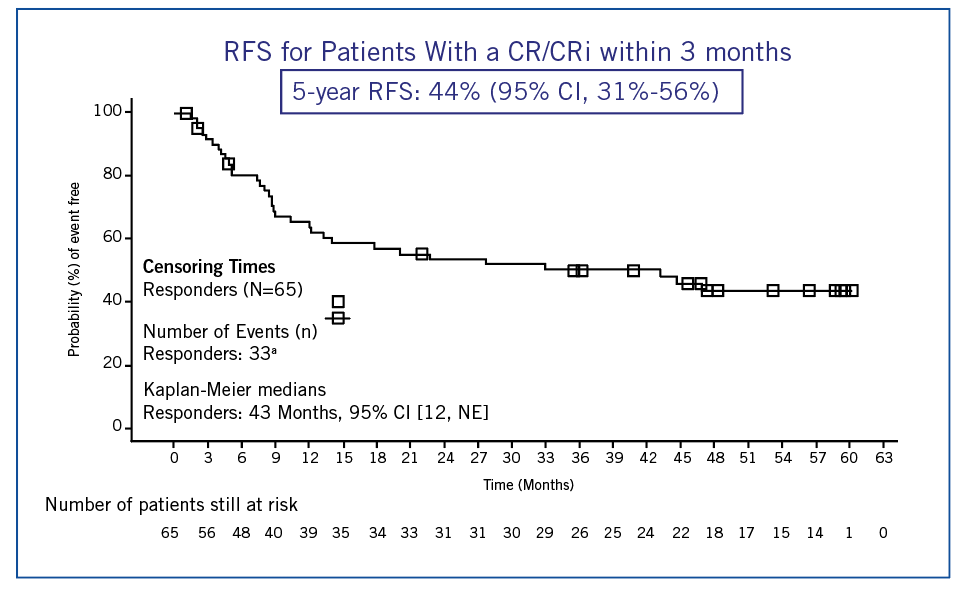
Figure 2 : survie sans rechute à 5 ans, cohorte ELIANA.
• Des données prometteuses à destination des LAL T en rechute ou réfractaire (Lu et al, abstract S110). L’inconvénient avec les CAR anti-CD7 est celui de la fratricidie (autodestruction des CAR T cells, puisque la cible est un marqueur T). Pour contourner ce problème, les auteurs ont l’idée d’opérer un KO du CD7 dans les lymphocytes T du patient issus de leucaphérèse, puis 24h après, une transduction avec un CAR anti-CD7 (41BB) dans ces même lymphocytes T.
Dans cette étude de phase 1, 15 patients sont inclus (10 LAL-T, 3 T-LBL, 2 MPAL) avec un âge médian de 28 ans. À J28, 100% des patients sont en RC avec une maladie résiduelle négative et après un suivi médian de 309 jours, 12 patients ont pu être allogreffés avec PFS médiane = 250 jours (11 encore en RC). La toxicité est décrite comme acceptable par les auteurs (figure 3),
avec des CRS de grade 3 chez 5 patients et des neurotoxicités de grade 3 chez 1 patient.
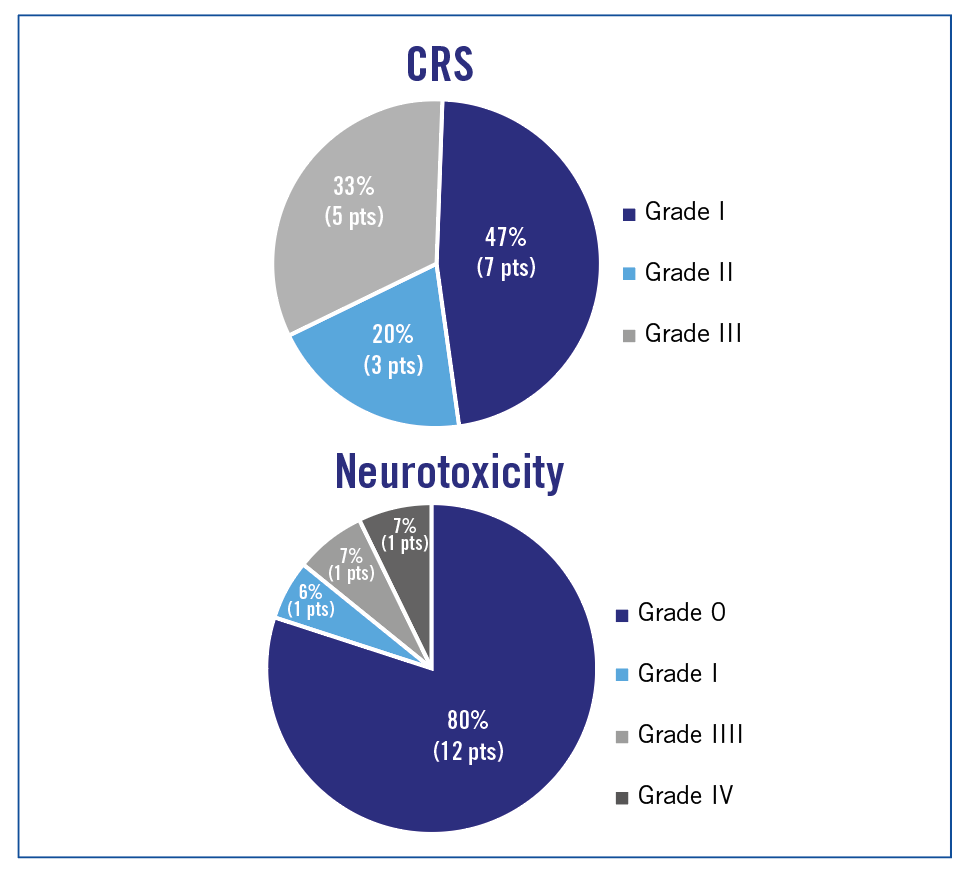
Figure 3 : toxicité CRS (cytokine release syndrom) et neurotoxicité.
L’asparaginase
L’asparaginase peut être considérée comme la première « thérapie ciblée » dans le traitement des LAL. Avec la fin de commercialisation de la L-asparaginase native, plusieurs groupes adultes sont passés à la PEGasparaginase, formulation pégylée d’asparaginase. Pour mémoire, voilà bien longtemps que les pédiatres utilisent cette formulation de PEGasparaginase. L’équipe italienne (Bassan et al., abstract S113) a présenté les résultats du protocole de traitement de première ligne des LAL Ph- de l’adulte comportant de la chimiothérapie et de la PEGasparaginase, 4 doses réparties entre induction et consolidations (posologie d’une dose : 2000 UI/m2 < 55 ans ; 1000 UI/m2 >55 ans). Les survies sans maladie et globale à 36 mois sont de 58 et 67% respectivement, ce qui est en accord avec les données publiées du GRAALL 2005(3). On note 5 décès en induction, rattachés à l’utilisation de la PEGasparaginase (coagulopathies, neurotoxicité et anomalie hépatiques). On attend beaucoup des études suivantes qui incorporent notamment des données de monitoring de l’activité asparaginase lors de l’utilisation de la PEGasparaginase et un algorithme de prescription de la PEGasparaginase en fonction du BMI, de la présence d’une stéatose hépatique et de l’existence d’effet secondaire lors des cycles précédents.
Références
1- Foà et al, NEJM 2020.
2- Maude et al, NEJM 2018.
3- Huguet et al, JCO 2018.
Dr Marie BALSAT, Lyon.


